余科教授团队发现KRAS突变非小细胞肺癌耐药新机制
发布日期:2024/1/16 0:00:00 阅读次数:2479

KRAS是最常见的致癌驱动基因之一,大约25%的非小细胞肺癌(NSCLC)患者携带突变的KRAS基因(KRASmut),其中KRAS-G12C是肺腺癌(LUAD)中最广泛的突变亚型。组织因子(Tissue factor, TF)在肿瘤的激活可以极大地促进癌症的恶性行为,且在肿瘤微环境(TME)影响治疗结果中扮演着越来越重要的角色。
复旦大学药学院、智能化递药教育部重点实验室余科教授课题组的研究方向之一是组织因子TF-治疗抗体的新药创制及其在肿瘤治疗的作用和机制,近日在期刊《Oncogene》上在线发表题为“Tissue factor overexpression promotes resistance to KRAS-G12C inhibition in non-small cell lung cancer”的研究论文,揭示了TF-mTORC2轴在巨噬细胞吞噬能力的负向调节中的作用,导致免疫逃逸和肿瘤细胞杀伤能力受损。这种影响可以通过TF敲减或TF/mTOR轴的药物靶向来逆转,以达到明显改善抗肿瘤的效果,确定了TF作为KRAS-G12C抑制剂耐药的一个新的和重要的机制。

本研究通过分析肿瘤转录组和组织芯片建立了TF与耐药肿瘤的关系,通过采用前期开发的TF抗体HuSC1-39和mTORC1/2抑制剂MTI-31(SCC31)揭示了TF在KRAS突变NSCLC中的功能作用,发现HuSC1-39在体内克服KRAS抑制剂耐药性的功效显著,肿瘤微环境(TME)的重塑可能参与其中。
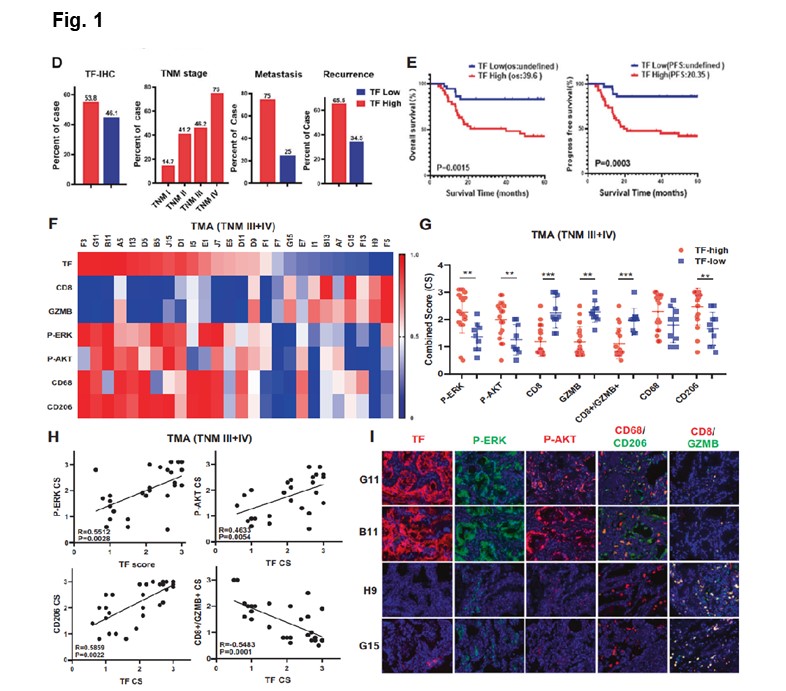
肿瘤微环境中富含肿瘤相关巨噬细胞(TAMs)。大多数TAMs是促进肿瘤生长的M2型巨噬细胞,而抑制肿瘤生长的M1型巨噬细胞则是少数。CSF1是主要由肿瘤产生的因子,负责M2型巨噬细胞的招募。在HuSC1-39或MTI-31处理的肿瘤中,虽然总的巨噬细胞(F4/80+)水平并没有受到很大影响,但M2型巨噬细胞(F4/80+CD206+)和CSF1的数量显著减少,激活的M1型巨噬细胞(F4/80+/CD86+)增加。在TF敲除的肿瘤中也观察到这种促进M1型巨噬细胞的机制。
通过免疫荧光法的展示,HuSC1-39、MTI-31治疗或TF敲除的肿瘤中,TNF-α分泌量显著增加。与MRTX849的联合治疗进一步减少了肿瘤内M2型巨噬细胞,表现出更强的M1型巨噬细胞表型,并具有最高水平的TNF-α。综上所述,HuSC1-39和MTI-31通过改变M2/M1巨噬细胞比例和激活M1型巨噬细胞功能来克服KRAS抑制剂的耐药性。
复旦大学药学院2019级博士生张宇为本文的第一作者,复旦大学药学院余科教授为本文的通讯作者。该研究获得国家自然科学基金、国家科技支撑计划重大项目、科技成果转化等基金的资助。
原文链接:https://www.nature.com/articles/s41388-023-02924-y