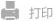多效性微环境重编程胶束通过抑制神经元铁死亡和胶质细胞过度激活来治疗脑缺血再灌注损伤
发布时间:2023/9/20 9:28:57 阅读次数:805
近日,针对脑缺血再灌注损伤,复旦大学药学院蒋晨教授研究团队基于其复杂的病灶微环境,设计并且制备了ROS响应型的病灶靶向载艾地苯醌(Idebenone, IDBN)聚合物胶束,可以增加多效性治疗药物IDBN在缺血半暗带的蓄积,进而抑制神经元铁死亡及胶质细胞的过度激活,系统调控病灶微环境,有效改善脑缺血再灌注损伤。相关研究成果以“Pleiotropic Microenvironment Remodeling Micelles for Cerebral
Ischemia-Reperfusion Injury Therapy by Inhibiting Neuronal Ferroptosis and
Glial Overactivation”为题,在线发表于《ACS Nano》,2018级博士研究生李潮为第一作者,蒋晨教授为通讯作者。
由脑动脉闭塞引起的急性缺血性中风是一种危险的脑血管疾病,具有很高的致残和死亡风险。 虽然溶栓和血栓切除等治疗可以有效恢复半暗带的血液供应,但成功的再灌注也会导致严重的继发性脑损伤,严重损害再通后的神经元存活。再灌注损伤是一个复杂的病理生理过程,包括许多相互关联的途径。最新研究发现,氧化应激诱导的神经元铁死亡和胶质细胞的过度激活在该过程中发挥重要作用。铁死亡是一种新发现的调节性细胞死亡方式,其依赖于氧化应激介导的脂质过氧化物的产生和积累,导致细胞膜破裂和同步的细胞铁死亡,并伴有广泛的组织损伤。经历铁死亡的神经元释放损伤相关分子模式 (DAMP),快速激活和招募小胶质细胞,诱导 NADPH 氧化酶和 ROS 产生的上调。 此外,大量研究表明,ROS 还可以充当促炎信号分子来激活小胶质细胞。过度激活的小胶质细胞会分泌促炎细胞因子和趋化因子,吸引星形胶质细胞和外周白细胞,加剧神经炎症和氧化应激。最终,氧化应激、神经元铁死亡和炎症反应之间形成相互促进和自我放大的恶性循环,形成损害神经元存活的病灶微环境。尽管对作用于单一机制/靶点的神经保护剂进行了广泛的研究,但尚未有成功的临床应用,这凸显了从单靶点药物转向多效性治疗以改善治疗结果的紧迫性。
在这项研究中,我们开发了一种负载多效性药物--IDBN的靶向交联聚合物胶束,通过抑制神经元铁死亡和胶质细胞过度激活来拯救缺血半暗带。在模型鼠中,CREKA 肽修饰的胶束通过与缺血侧脑血管中的微血栓结合而实现在受损大脑中的蓄积。在ROS的刺激下,胶束外层交联的疏水二硒键转化为亲水性硒酸,从而实现同步 ROS 消耗和响应药物释放。释放的IDBN可清除ROS,防止氧化应激诱导的神经元铁死亡,减弱胶质细胞过度激活,并抑制促炎因子分泌,从而调节病灶微环境。与对照组相比,胶束处理显著增强了神经元的存活,减少了梗塞体积,并改善了行为功能。这种多效性治疗胶束为通过抑制神经元铁死亡和胶质细胞的过度激活来重塑病灶微环境以治疗脑缺血再灌注损伤提供了概念验证。

多效性载IDBN靶向聚合物胶束调控病灶微环境的示意图
该研究获得国家自然科学基金,上海市科技重大专项及张江实验室的支持。
原文链接:https://pubs.acs.org/doi/full/10.1021/acsnano.3c05038.