具有双重免疫调节功能的纳米材料用于乳腺癌脑转移的协同治疗
发布时间:2023/6/28 14:20:09 阅读次数:877
由于缺乏针对性的治疗手段,三阴性乳腺癌脑转移患者预后不佳。虽然免疫疗法为肿瘤治疗带来了希望,但受限于转移细胞较差的免疫原性和强大的免疫抑制微环境,三阴性乳腺癌脑转移患者还没有从免疫疗法中获益。增强免疫激活和改善免疫抑制微环境的双重免疫调节策略为患者提供了新的治疗选择。在此,我们提出了微环境调节-化疗-免疫协同增敏的类鸡尾酒治疗策略,并构建了还原敏感的免疫微环境调节纳米材料用于乳腺癌脑转移治疗的探索。相关成果以Nanomaterials with dual immunomodulatory functions for
synergistic therapy of breast cancer brain metastases为题,在线发表于国际知名期刊Bioactive Materials (IF2022 = 18.9)。
脑转移(BM)是最常见的内源性脑瘤类型,大约30%的乳腺癌患者会发生脑转移。其中,三阴性乳腺癌(TNBC)患者脑转移率高达46%,并且具有最差的治疗效果(中位生存期仅为4.9个月)。TNBC脑转移目前主要采取姑息疗法,但由于血脑屏障(BBB)的存在和转移的多发性,常规化疗和手术都没有取得明显的治疗效果。目前尚无有效的临床治疗方案,因此迫切需要寻找新的治疗策略。
由于免疫系统在各种新兴治疗策略中的潜力,免疫疗法已经引起了研究人员的关注。然而,迄今为止,基于免疫的策略受到传统观念的限制,即三阴性乳腺癌症的免疫原性极低。重编程肿瘤微环境(TME),将“冷”肿瘤转化为“热”肿瘤,从而提高免疫治疗效果的方法正在被开发。但免疫疗法在脑转移中的应用还有一个重要的挑战,即中枢神经系统(CNS)被认为是免疫豁免的。加之传统药物对大脑的渗透有限,脑转移患者被排除在许多涉及免疫疗法的临床试验之外,限制了免疫疗法在乳腺癌脑转移中的应用。虽然有明确的证据表明T细胞在乳腺癌脑转移灶中浸润,但肿瘤浸润淋巴细胞(TILs)的比例相对于外周转移较低。通过免疫原性细胞死亡(ICD)激活适应性免疫可以延长脑转移小鼠的生存期,这表明增加T细胞在脑转移灶的浸润可能是提高乳腺癌脑转移治疗效果的有效策略。
虽然TILs的存在通常与更好的预后和更高的免疫疗法反应率有关,但TME中免疫抑制成分的存在与肿瘤的治疗抵抗有关。脑部微转移灶的建立需要炎症性成分,包括大脑内各种免疫细胞和星形胶质细胞的早期浸润和重新编程,进而发展为 "转移前生态位"。信号转导和转录激活因子3(STAT3)在转移肿瘤细胞和星形细胞中被异常激活,并通过细胞间信号传导促进下游促癌信号分子的合成和分泌,从而诱导肿瘤相关巨噬细胞(TAM)的M2极化,抑制CD8+T细胞的浸润,形成免疫抑制性转移微环境。水飞蓟宾是一种针对这些信号轴的STAT3抑制剂,已被证明可以改善乳腺癌脑转移的治疗效果。因此,通过抑制STAT3磷酸化来改善免疫抑制的微环境调控策略代表了一种有希望的脑转移治疗方式。
基于BBB穿透和转移灶内药物集中释放的微环境调节-化疗-免疫协同增效的类鸡尾酒治疗策略,我们构建了具有双重免疫调节功能的纳米材料(SIL@T),通过递送水飞蓟宾改善免疫抑制的微环境、递送奥沙利铂增加TILs的浸润。通过在表面锚定IGF-1R的配体类似物,SIL@T可以穿透BBB并靶向脑转移灶。在被转移肿瘤细胞内化后,胶束结构被破坏,释放水飞蓟宾抑制STAT3的磷酸化,并在还原性的细胞质环境中响应释放奥沙利铂诱发ICD。三阴性乳腺癌脑转移模型小鼠的药效学结果也显示,SIL@T可以刺激树突状细胞的成熟,增加CD8+T细胞在转移区域的浸润,同时抑制转移肿瘤中STAT3的激活,改善免疫抑制的转移微环境,显著延长转移模型小鼠的生存时间。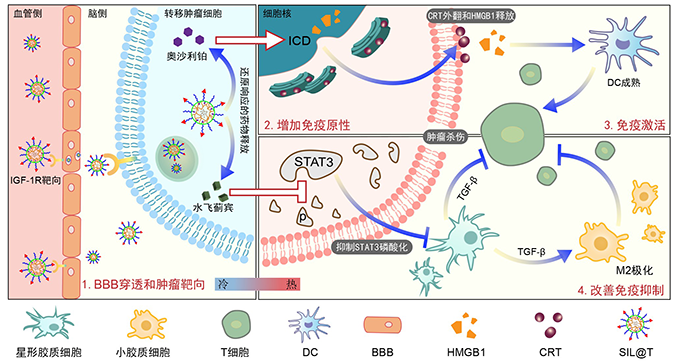
本课题组博士研究生赵振浩为论文的第一作者,蒋晨教授为论文的通讯作者。该研究获得国家自然科学基金,上海市学术研究带头人计划等项目支持。
原文链接:https://www.sciencedirect.com/science/article/pii/S2452199X23001378