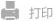用于在胰腺癌联合疗法中克服基质屏障和逆转免疫抑制的触发转胞吞作用的纳米颗粒
发布时间:2025/2/11 15:39:48 阅读次数:1977
在胰腺导管腺癌(PDAC)中,基质细胞和基质蛋白形成了一道致密的物理屏障,这道屏障在阻止肿瘤细胞外侵的同时,也限制了药物和CD8+ T细胞的向肿瘤内渗透。此外,过度激活的TGF-β/SMAD信号通路进一步促进了基质增生和免疫抑制。因此,穿透基质屏障的同时保留基质完整性、在肿瘤内部释放药物、重塑基质以及激活免疫系统是一种有前景的药物递送策略。在本研究中,我们制备了一种烯胺N-氧化物修饰的纳米颗粒,其中包裹了硬脂酸修饰的吉西他滨前药(GemC18)和pSMAD2/3抑制剂galunisertib。纳米颗粒表面的烯胺N-氧化物可以触发转胞吞作用,随后响应缺氧和酸性微环境,将纳米颗粒表面电荷转变为正电荷,从而增强其穿透能力。释放的galunisertib可抑制TGF-β/SMAD信号通路,重塑基质,激活抗肿瘤免疫反应,并与吉西他滨(Gem)联合发挥杀伤肿瘤细胞的作用。相关成果以Transcytosis-Triggering Nanoparticles for Overcoming Stromal Barriers and Reversing Immunosuppression in Pancreatic Cancer Combinatorial Therapy为题,在线发表于国际知名期刊Nano Letters (IF=9.6)。
PDAC是致死性极高的肿瘤之一,肿瘤中约90%由致密的基质组成,这些基质包裹肿瘤细胞,形成物理屏障。目前,临床化疗旨在通过紫杉醇消除基质,增加了Gem的瘤内浓度,但这也导致肿瘤转移,患者的生存时间仅有限增加(8.5个月vs 6.7个月)。因此,更优的策略是寻找能够跨越基质屏障的药物递送模型,而不是简单粗暴地破坏基质。
最近的研究表明,转胞吞作用作为一种在细胞水平上克服PDAC基质屏障的递送策略具有前景。N-氧化物修饰的两性离子聚合物可以通过吸附介导的转胞吞作用(AMT)将药物递送至实体瘤内部。因此,开发基于N-氧化物的触发转胞吞作用的药物递送系统将为跨越PDAC基质屏障提供合理的递送策略。
另一方面,PDAC基质包括复杂的细胞成分,如癌相关成纤维细胞(CAFs)、免疫细胞和胰腺星状细胞(PSCs),以及非细胞成分,如胶原蛋白、透明质酸和纤维连接蛋白。过度增生的基质会加剧缺氧、酸性和免疫抑制微环境,促进肿瘤生长。在这种复杂的肿瘤微环境中,TGF-β/SMAD信号通路起着关键作用。TGF-β/SMAD信号通路在激活CAFs和PSCs方面发挥关键作用,这些细胞在被激活后会分泌大量胶原蛋白和透明质酸。胶原蛋白和纤维连接蛋白是细胞外基质(ECM)沉积的主要蛋白质,而过度的ECM沉积会压迫肿瘤血管,严重影响淋巴引流,并与过度增殖的肿瘤细胞一起形成与平均动脉压相当的间质压力,排斥药物。此外,血管系统的崩溃导致肿瘤内氧气供应不足,形成梯度缺氧微环境。因此,TGF-β/SMAD信号通路间接加剧了肿瘤的缺氧。在缺氧微环境中,肿瘤细胞过表达谷胱甘肽(GSH)以解毒活性氧(ROS),保护肿瘤细胞免受氧化损伤,降低化疗的效果。同时,在缺氧环境中,肿瘤细胞通过糖酵解产生大量乳酸,形成酸性微环境。肿瘤中积累的乳酸可以抑制CD8+ T细胞和自然杀伤细胞,同时促进FOXP3+调节性T细胞(Tregs)和髓源性抑制细胞(MDSCs)的免疫抑制功能。此外,致密的基质形成了物理屏障,阻碍了CD8+ T淋巴细胞的浸润。因此,TGF-β/SMAD信号通路也间接加剧酸性微环境和免疫抑制微环境。更严重的是,TGF-β/SMAD信号通路还会直接导致免疫抑制。大量研究表明,TGF-β/SMAD信号通路的过度激活会诱导M1型肿瘤相关巨噬细胞(M1 TAM)向M2型肿瘤相关巨噬细胞(M2 TAM)转化,增加Tregs的比例,并抑制CD8+ T细胞。总之,PDAC的致密基质形成的物理屏障与缺氧、酸性和免疫抑制微环境密切相关。因此,直接干预TGF-β/SMAD信号通路可以改变肿瘤微环境,并与吉西他滨治疗相结合,取得显著效果。
图1. 递送系统的构建方式和体内过程的示意图
在此,我们成功开发了一种具有转胞吞和缺氧响应功能的药物递送系统(GemC18/Gal@CPLNO),该功能由烯胺N-氧化物介导。纳米颗粒表面的烯胺N-氧化物触发转胞吞作用跨越肿瘤基质的外层屏障,随后在肿瘤内的缺氧环境中被逐步还原为叔胺衍生物,释放的不饱和亚胺离子可以与GSH发生迈克尔加成反应。同时,聚合物上的赖氨酸残基响应肿瘤的酸性微环境,使纳米颗粒的表面电位从中性变为正电,继续触发转胞吞作用。随后释放的galunisertib可以抑制TGF-β/SMAD信号通路,抑制CAFs的激活,重塑PDAC的免疫抑制微环境,在与吉西他滨联合使用时实现协同治疗效果。
本课题组硕士研究生张世林为论文的第一作者,孙涛副教授和蒋晨教授为共同通讯作者。
原文链接: https://doi.org/10.1021/acs.nanolett.4c06372