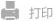尺寸电荷双重转换的药物递送系统用于针对胰腺癌的化疗增敏并增强免疫浸润
发布时间:2024/12/3 15:03:36 阅读次数:2282
胰腺导管腺癌(PDAC)是一种起源于胰腺(腹膜后器官)的腺体形成性恶性肿瘤。其发病率较低,但近年来有所增加,每年每10万人中约有13例,终生风险低于2%,且不存在性别或地域差异。本研究旨在将肿瘤细胞与肿瘤微环境之间的相互作用转化为有前景的治疗方案。吉西他滨是临床一线化疗药物,但其临床有效反应率仅为10%~20%。吉西他滨耐药的一个主要因素是细胞外基质(ECM)相互缠绕形成的致密纤维化网络,该网络对肿瘤细胞起到保护作用。癌细胞通过刺激成纤维细胞以旁分泌方式上调胶原家族蛋白的表达。ECM蛋白(包括胶原和透明质酸)因结缔组织增殖反应而沉积,导致间质流体压力升高和肿瘤内血管密度降低。致密的间质屏障不仅是物理屏障,也是生物功能屏障,它限制了抗肿瘤活性药物的正常扩散并阻碍了免疫细胞的浸润;因此,间质屏障在PDAC的进展和治疗中发挥着关键作用。近年来,使用纳米材料进行PDAC药物递送的研究有所增加,纳米疗法的许多优势也已被发现,其众所周知的益处包括药物控释、循环时间延长、副作用减轻以及能够共递送多种治疗药物。
针对PDAC间质,已开发出多种治疗方案,研究重点集中在间质屏障的破坏上。当间质屏障被破坏时,化疗药物能更容易地接近肿瘤并杀死肿瘤细胞;然而,盲目消融间质屏障往往会导致不良后果,如肿瘤转移。此外,单纯破坏间质屏障无法重塑胰腺癌肿瘤微环境。在ECM相互作用蛋白中,盘状结构域受体1(DDR1)与肿瘤进展和药物耐药性关系最为密切。DDR1属于受体酪氨酸激酶的一个亚家族,其特征是通过与多种类型的胶原(如I型胶原)相互作用来调节细胞增殖和分化。DDR1被激活后,通过DDR1-NF-κB-p62-NRF2信号传导促进PDAC生长。研究表明,吉西他滨诱导的氧化应激通常伴随着抗氧化反应的增加,包括NRF2表达增加,这阐明了吉西他滨诱导胰腺癌药物耐药性的机制。当使用DDR1抑制剂阻断这一信号轴时,NRF2受到抑制,细胞内氧化还原平衡被打破,过量活性氧物种(ROS)的积累导致线粒体功能障碍并启动凋亡程序,从而恢复胰腺癌细胞对吉西他滨的敏感性。同时,已有研究表明DDR1可促进胶原纤维的排列,从而增强肿瘤对免疫浸润的防御能力。当DDR1受到抑制时,胶原排列被打乱,减弱了免疫排斥反应并抑制了免疫健全宿主体内的肿瘤生长。因此,在本研究中,我们使用酪氨酸激酶抑制剂达沙替尼来抑制DDR1-NF-κB-NRF2信号轴,以恢复吉西他滨的化疗杀伤作用,并打乱间质中的胶原排列,从而调节PDAC的免疫抑制微环境。

图1. 递送系统的构建方式和体内过程的示意图
在针对胰腺癌设计药物递送策略时,必须考虑递送系统渗透进入肿瘤的过程。促进渗透的最常见策略是设计用于多阶段释放的纳米颗粒,并利用跨细胞转运。多阶段释放通常涉及较大尺寸的递送系统在肿瘤微环境的触发下转变为更小的递送系统,以增加其在肿瘤间质中的扩散。此外,跨细胞转运也以多种形式发生,其中带正电的纳米药物能有效诱导吸附介导的跨细胞转运,并显著促进向实体肿瘤的渗出。然而,在静脉注射后,大量血浆蛋白会迅速吸附到循环纳米颗粒的阳离子表面,形成蛋白冠并产生调理作用,带正电的纳米药物会迅速被单核吞噬细胞系统从血液中清除。
因此,在本研究中,我们使用对胰腺癌(PDAC)缺氧微环境响应性的连接单元来交联带正电的树枝状L-赖氨酸(DGL)。吉西他滨通过化学键偶联到DGL的表面,DGL的空腔用于装载疏水药物达沙替尼,并使用靶向富含于PDAC间质中的蛋白——生腱蛋白C的核酸适配体对递送系统的表面进行电荷掩蔽,从而使其表面带负电。当其到达胰腺肿瘤部位时,位于表面的核酸适配体GBI-10首先脱落,导致递送系统的表面电荷从负变为正。当其渗透能力增强后,接触缺氧环境,连接单元中的化学键断裂导致尺寸减小,从而能够更深入地渗透到胰腺癌组织中。与此同时,吉西他滨和达沙替尼被释放,这两种药物之间的相互作用逆转了胰腺癌细胞对化疗的耐药性,并增强了免疫细胞在肿瘤组织内的浸润。
课题组博士研究生宋昊霖为第一作者,蒋晨教授为通讯作者。相关研究成果以“Size and Charge Dual-switchable Nanoparticles for Achieving Chemo-sensitization and Immune Infiltration Against Pancreatic Ductal Adenocarcinoma”为题,在线发表于《Advanced Functional Materials》, IF = 18.5。该研究得到了国家自然科学基金委,国家重点研发计划,上海市科技重大专项和张江实验室的支持。
原文链接:https://doi.org/10.1002/adfm.202411643