巨噬细胞伪装的MnO2纳米粒通过减弱氧化应激水平和调节炎症微环境以实现急性缺血性中风的神经保护治疗
发布时间:2021/8/30 14:42:32 阅读次数:1574
Advanced Science: 巨噬细胞伪装的MnO2纳米粒通过减弱氧化应激水平和调节炎症微环境以实现急性缺血性中风的神经保护治疗
近期,本课题组开发了一种巨噬细胞膜包裹的载芬戈莫德MnO2纳米粒用于脑缺血再灌注后损伤的治疗。相关成果以《巨噬细胞伪装的MnO2纳米粒通过减弱氧化应激水平和调节炎症微环境以实现急性缺血性中风的神经保护治疗》(Macrophage-Disguised Manganese Dioxide Nanoparticles for Neuroprotection by Reducing Oxidative Stress and Modulating Inflammatory Microenvironment in Acute Ischemic Stroke)为题,在线发表于Advanced Science(2021, 2101526)。
急性缺血性中风通常由血栓阻塞脑血管引起,是全球死亡和残疾的主要原因之一。实现再灌注以挽救缺血半暗带中受损的神经元是大多数干预措施的主要目标。然而,恢复血流再通的幸存者仍面临残疾的风险,主要是由血供重建后的继发性再灌注损伤所致。此外,闭塞的近端动脉的再通并不一定会导致已形成微血栓的下游微血管的再灌注。微循环受损会限制临近神经元获得必要的氧气,从而进一步导致神经元死亡。减少再灌注损伤和最小化微循环障碍造成的伤害仍然是治疗缺血性中风的主要挑战。
与神经胶质细胞和血管细胞相比,神经元及其脆弱,在缺血条件下会迅速丧失正常功能。缺血和再灌注可引发级联反应,如氧化应激和炎症反应,最终导致不可逆的神经元损伤。过量产生的活性氧(ROS)是氧化应激的主要来源,已有研究证明清除过量的ROS可以有效减缓神经元的死亡进程,改善预后。然而,对于受微循环功能障碍影响的神经元,仅消除过量的ROS远远不足以维持其稳态平衡。在临床前研究中,基于纳米技术的O2输送系统,如载有血红蛋白的脂质体,被用来挽救缺血的大脑。然而,不精确地输送O2可能会导致ROS的意外增加。在拯救神经元的过程中,清除ROS和O2的输送之间的平衡仍然是一个巨大的挑战。二氧化锰(MnO2)纳米粒子可以消耗过量的过氧化氢(H2O2)并原位将其转化为O2,这一过程与ROS的异常生成过程相反。预计将MnO2纳米粒精确递送到缺血脑可以有效地挽救受损的神经元。
此外,受损的神经元会释放相关信号分子,激活和招募大脑中固有的小胶质细胞。 M1型(促炎型)小胶质细胞会释放炎症介质,构建促炎微环境,进一步破坏神经元。大量研究表明,小胶质细胞的功能与其表型密切相关,促进小胶质细胞从M1向M2(抗炎型)极化可以减弱炎症反应,挽救受损神经元。已证明消除ROS可通过抑制NF-κB通路的激活来抑制小胶质细胞中促炎因子的分泌。此外,一些药物,如芬戈莫德 (FTY),也可以使缺血脑中的小胶质细胞向M2型极化。
血脑屏障(BBB)限制了大多数治疗药物进入大脑,这在维持脑内稳态的同时阻碍了脑部疾病的治疗。尽管BBB的完整性在缺血和再灌注过程中被部分破坏,为药物到达病变提供了机会,但基于BBB短暂开放的纳米药物的效果仍有待进一步提高,因为不同个体之间缺血的严重程度,BBB的开放程度和开启时间窗差异很大。在缺血和再灌注过程中,细胞间粘附分子在应激状态下的血管内皮细胞的管腔内侧过度表达。这些分子可以与从外周血募集的白细胞上的相应配体相互作用,促进其向病灶的浸润,且募集不受血脑屏障开放性的影响。最近,对细胞膜包裹仿生纳米药物进行了广泛研究,从细胞继承的天然特性有利于帮助纳米颗粒降低其免疫原性并延长半衰期。此外,白细胞来源的细胞膜已被证明赋予纳米粒准确靶向炎症病变的能力。巨噬细胞在数小时内被募集并渗入缺血脑中,因此,巨噬细胞膜包裹是将纳米颗粒准确递送至缺血病变的有前景的策略。
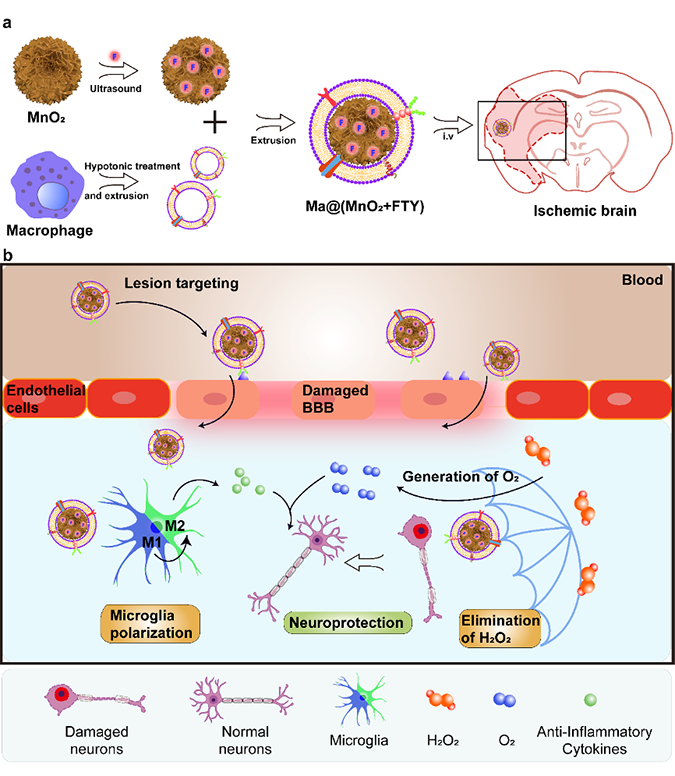
基于此,本课题组构建了巨噬细胞包裹的的负载FTY的MnO2纳米粒(Ma@(MnO2+FTY)),该体系通过消耗ROS、产生O2及逆转促炎微环境以用于挽救缺血半暗带。巨噬细胞膜包裹赋予纳米粒对炎症病灶的趋化能力。具有高表面积的MnO2纳米粒可以有效地消耗过量的ROS并产生O2来拯救垂死的神经元。消耗ROS还可以抑制小胶质细胞中NF-κB信号通路的激活,从而减弱促炎反应。通过静电相互作用封装在MnO2纳米粒中的FTY可以通过激活STAT3通路促进小胶质细胞向M2表型转变,从而逆转促炎微环境。结果表明,降低氧化应激与调节促炎微环境相结合的策略,可在治疗缺血性脑卒中中实现协同神经保护作用。
课题组博士生李潮为论文的第一作者,蒋晨教授为论文的通讯作者。该研究获得国家自然科学基金项目支持。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202101526