ACS Appl. Mater. Interfaces:含有点击核酸的纳米平台通过自噬和糖酵解的双向调节诱导肿瘤细胞稳态崩溃
发布时间:2021/1/8 14:49:50 阅读次数:2628
近期,本课题组开发了一种含有点击核酸结构的核酸-小分子药物共递送纳米平台用于抗三阴性乳腺癌的研究。近日,相关成果以《含有点击核酸的纳米平台通过自噬和糖酵解的双向调节诱导肿瘤细胞稳态崩溃》(Click-Nucleic-Acid-Containing Codelivery System Inducing Collapse of
Cellular Homeostasis for Tumor Therapy through Bidirectional Regulation of
Autophagy and Glycolysis)为题,在线发表于ACS Applied Materials
& Interfaces(2020, 12, 52, 57757–57767)。
自1927年Warburg 发现肿瘤的代谢异常以来,肿瘤的疾病本质一直是我们探索的焦点,肿瘤的代谢异常导致其对营养物质和能源的需求大幅提高,这时肿瘤就会通过糖、氨基酸脂肪酸等代谢途径重编程获得营养物质和能量的补充,其中大于50%的肿瘤供能由糖代谢提供。因此,已有许多研究试图通过抑制肿瘤的糖代谢重编程来杀伤肿瘤细胞,但是由于肿瘤代谢途径的多样性,它很容易通过多种代谢通路代偿补充,比如当肿瘤处在缺乏能量和营养的状态时,会通过适度激活自噬来维持细胞存活。因此从单一途径抑制肿瘤糖代谢无法实现全局化的肿瘤代谢调控。
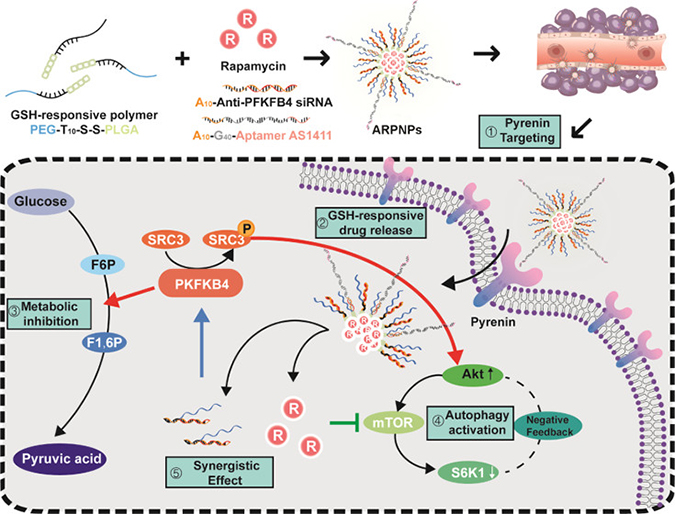
肿瘤优先依赖糖酵解,以不依赖氧气的方式生产能量。6-磷酸果糖-2-激酶/果糖-2,6-双磷酸调节酶4(PFKFB4),是肿瘤糖酵解途径的关键酶,也是肿瘤代谢异常的重要标志之一,高表达于肿瘤组织。最近的研究表明,PFKFB4是肿瘤侵袭转移相关基因类固醇受体共激活因子3(SRC-3)的激活剂。在SRC3 / Akt / mTOR通路基础上,这一新发现表明PFKFB4可作为糖酵解和自噬的分子支点促进肿瘤的转移和侵袭从而成为潜在的肿瘤治疗靶点。
自噬在代谢应激过程中通过降解受损的细胞器和蛋白获取物质和能量的补充,维持细胞稳态。研究表明,在肿瘤的乏氧或贫养区自噬水平显著升高,并通过该途径促进肿瘤细胞存活。但与此同时自噬是一把双刃剑,化疗药物促进的过度自噬可以促进肿瘤细胞的凋亡。此外,自噬还与近年来备受关注的肿瘤的免疫治疗有着紧密的联系。研究表明,自噬可调节NK细胞,巨噬细胞,树突状细胞,以及淋巴细胞,影响其稳态、存活、激活、增殖和分化,从而作用于非特异性免疫和特异性免疫。在非特异性免疫中,自噬通过激活非特异性免疫受体(包括TLR和NLR),促进下游一系列免疫效应,包括NKT细胞的激活,细胞因子分泌和非特异性吞噬作用。在特异性免疫中,自噬可提供大量抗原,加载到II类MHC分子上,并通过抗原提呈细胞激活CD8 + T细胞。
然而,由于自噬在抑制肿瘤和促进肿瘤生长中的双重作用,仅仅使用一些自噬调节剂,比如雷帕霉素和氯喹,常常不能获得令人满意的治疗效果。必须确保治疗中自噬的走向。而作为糖酵解和自噬的分子桥梁,上述PFKFB4分子的下调可以通过抑制SRC3 / Akt / mTOR通路,导致自噬朝着促进肿瘤细胞凋亡的方向发展。
因此,提出了包括自噬调节剂雷帕霉素和PFKFB4的siRNA在内的共同递送策略,以同步调节糖酵解和自噬,在抑制肿瘤代谢的同时确保自噬方向,以发挥有效的抗肿瘤作用。近年来,纳米给药系统用于肿瘤药物递送系统的研究屡见报道,与传统化疗相比,纳米给药系统可通过被动靶向或主动靶向的策略,将药物有效输送至肿瘤组织或细胞,降低不良反应,提高化疗药物的效果。此外,纳米给药系统可用于化学药物和核苷酸药物的共同药物递送,同时改善核苷酸药物的不稳定性和非选择性。两亲性三嵌段共聚物聚乙二醇-聚胸腺嘧啶-聚(乳酸-共-羟基乙酸)(PEG-T10-S-S-PLGA)通过碱基互补配对负载核酸药物,具有良好生物相容性的PLGA用于包封疏水药物雷帕霉素。为了使得siRNA和雷帕霉素能够同时到达肿瘤细胞并在细胞的不同位置发挥作用,谷胱甘肽敏感的二硫键被引入聚合物中。此外,纳米粒表面使用核仁素靶向适配体AS1411修饰以增强其在肿瘤部位的蓄积。新型ARPNPs纳米粒具有诱导肿瘤自噬,原位肿瘤破坏和肿瘤免疫活化的潜力。通过激活免疫力同时有效杀死肿瘤细胞,在原位和转移性肿瘤模型的药效学研究中均观察到良好的治疗效果,这表明ARPNPs可以很好地作为一种有前景的肿瘤治疗策略。该平台还为多种核酸和不溶性化疗药物的代码交付提供了新思路。
课题组博士生郭沁为论文的第一作者,蒋晨教授为论文的通讯作者。该研究获得国家自然科学基金项目支持。
原文链接:https://pubs.acs.org/doi/full/10.1021/acsami.0c18361