顺序触发的细菌外膜泡用于巨噬细胞代谢的调节和肿瘤转移抑制
发布时间:2021/9/1 10:04:05 阅读次数:1023
近期,本课题组开发了一种具有肿瘤微环境响应逐级释放功能的细菌外泌囊泡,并进行了抗三阴性乳腺癌的研究。近日,相关成果以《顺序触发的细菌外膜泡用于巨噬细胞代谢的调节和肿瘤转移抑制》(Sequentially-Triggered Bacterial Outer Membrane Vesicles for Macrophage Metabolism Modulation and Tumor Metastasis Suppression)为题,在线发表于国际顶尖期刊《ACS Nano》。
肿瘤微环境(Tumor microenvironment, TME)中不同类型细胞之间的代谢相互作用往往导致其代谢重编程,使之完全不同于其正常生理过程。肿瘤内代谢机制的改变被认为能够支持肿瘤的维持和生长,竞争性地抑制抗肿瘤免疫。许多研究试图通过调节肿瘤和其他细胞在TME中的代谢来抑制肿瘤生长和激活肿瘤免疫。然而,代谢抑制剂往往受到肿瘤异质性的影响,在TME中,恶性细胞与其他细胞的有利代谢调节往往不一致。
例如,巨噬细胞作为实体肿瘤中占细胞总数50%以上的细胞类型,其在TME中的代谢特征会影响其表型以及在肿瘤中的作用。尽管抑制肿瘤细胞中的糖酵解被认为是一种很有前景的肿瘤抑制策略,但最近的研究表明,在缺氧环境下,肿瘤细胞可以通过抑制巨噬细胞中的糖酵解来减少巨噬细胞与新生血管上皮细胞对葡萄糖的竞争,从而促进肿瘤转移。一些对患者无效代谢策略在肿瘤细胞的体外实验中被证明是非常有效的,这表明患者的耐药性可能是由于肿瘤细胞的外部机制。
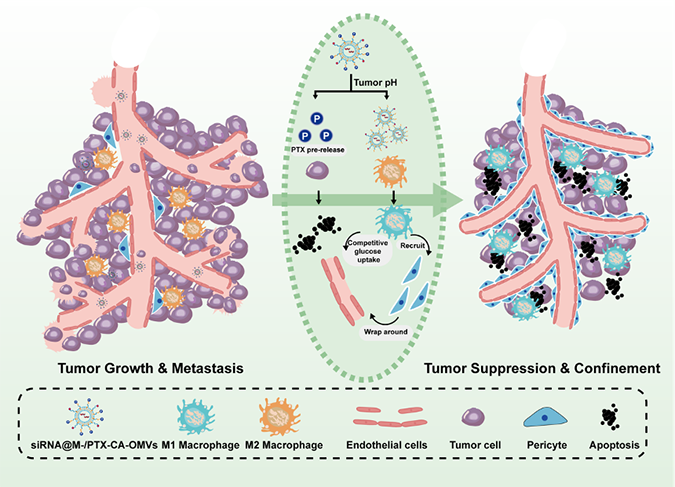
为了解决这一难题,我们开发了一种针对TME中不同细胞逐级释放的药物递送系统。我们利用减毒的革兰氏阴性菌的外膜囊泡(OMVs)共负载紫杉醇(PTX),调控发育和DNA损伤反应1 (Redd1)-siRNA,调控肿瘤代谢微环境,抑制肿瘤生长。我们的递送系统可以率先由肿瘤组织液酸性微环境触发释放的PTX。其余部分由表面修饰的甘露糖介导,由M2巨噬细胞摄取,增加M2巨噬细胞糖酵解水平,提高其与肿瘤血管内皮细胞竞争葡萄糖的能力。该纳米平台在三阴性乳腺癌模型中展现出有效的巨噬细胞调节、肿瘤免疫激活和抗肿瘤效果。
课题组博士研究生郭沁为论文的第一作者,蒋晨教授为论文的通讯作者。该研究获得国家自然科学基金,上海市学术研究带头人计划等项目支持。
原文链接:https://doi.org/10.1021/acsnano.1c05613